ÁTOMOS AISLADOS
Únicamente las sustancias llamadas "gases nobles" están presentes en la naturaleza como átomos aislados. Los elementos situados en el grupo 18 de la tabla periódica tienen su último nivel electrónico completo con 8 electrones lo que les confiere un carácter muy estable y no suelen combinarse con ni consigo mismos no con otros elementos químicos.
ÁTOMOS UNIDOS
Prácticamente todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las intensas fuerzas que mantienen unidos los átomos en las
distintas sustancias se denominan enlaces químicos.
¿CÓMO SE UNEN LOS ÁTOMOS? LOS ENLACES QUÍMICOS
Las uniones entre átomos se llaman enlaces y las propiedades de las sustancias dependen en gran medida del tipo de los enlaces que unen sus
átomos. Hay tres tipos de enlaces: iónico, covalente y metálico.
Los átomos se unen porque así adquieren una situación más estable que cuando estaban separados. Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen en su último nivel es igual a ocho (como los gases nobles). Esta configuración electrónica es extremadamente estable y por eso están formados por átomos aislados, sin unirse a otros átomos, sin reaccionar entre si.
Este principio recibe el nombre de regla del octeto y aunque no es general para todos los átomos, es útil en muchos casos.
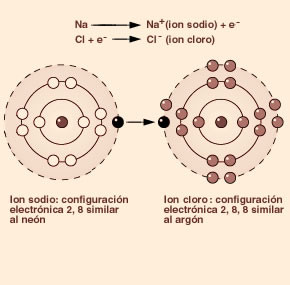
ENLACE IÓNICO
Cuando los átomos de un metal y un no metal se encuentran, el primero cede electrones a segundo. Como resultado, el metal se transforma en catión y el no metal en anión, es decir, dos iones con cargas eléctricas opuestas que, en consecuencia, se atraen entre sí. este tipo de enlace se conoce como enlace iónico.
Pulsa sobre la imagen para ver como se forma un enlace iónico
ENLACE COVALENTE

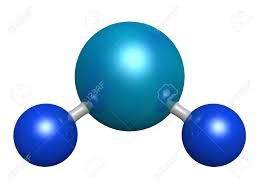
Este tipo de enlace se produce entre átomos de uno o más elementos no metálicos. Estos átomos tienen muchos electrones en su nivel más externo y tienen tendencia a ganar electrones más que a cederlos, para adquirir la estabilidad de la estructura electrónica de gas noble. El enlace se forma al compartir uno o más pares de electrones entre los dos átomos, uno procedente de cada átomo.
Pulsa sobre la imagen de la izquierda para ver cómo se forma un enlace covalente.
ENLACE METÁLICO
Los elementos metálicos poseen 1, 2 ó 3 electrones en la capa electrónica externa de sus átomos, los cuales están débilmente unidos al núcleo por lo que se pueden perder con facilidad.
Cuando un conjunto de átomos de estos elementos se acercan hasta estar lo más cerca posible, las capas electrónicas externas se solapan por completo, haciendo que los electrones ya no estén asociados a un átomo en concreto, sino que son compartidos por todos los átomos del conjunto.
¿QUÉ TIPO DE AGRUPACIONES FORMAN LOS ÁTOMOS?
MOLÉCULAS: agrupaciones de un número relativamente pequeño de átomos.
REDES CRISTALINAS O CRISTALES: son agrupaciones de millones de átomos que se ordenan en el espacio siguiendo un patrón que se repite en las tres dimensiones del espacio
CLASIFICACIÓN DE LAS SUSTANCIAS QUÍMICAS
SUSTANCIAS IÓNICAS
- Las sustancias iónicas son aquellas en que sus átomos están unidos por enlaces iónicos.
- Son compuestos químicos ya que se forman al agruparse iones de un elemento metálico con iones de uno no metálico.
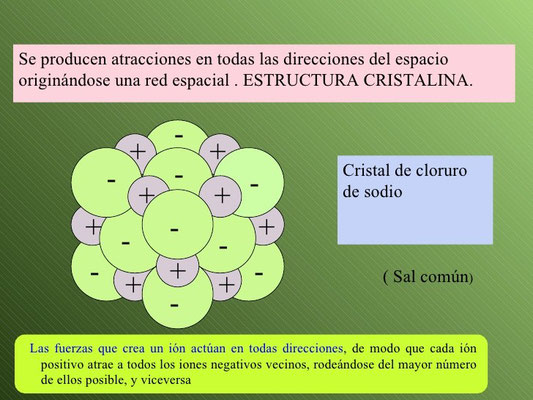
- Los iones se ordenan en el espacio formando redes cristalinas o cristales iónicos.
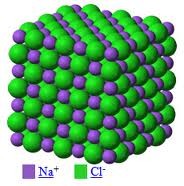
Esta atracción no se limita a un solo ion, sino que cada uno se rodea del máximo número de iones de carga opuesta que pueden rodear a un ion en particular posible. El resultado es un cristal iónico, como el que observamos en la imagen que corresponde al NaCl, cloruro sódico o sal común.
En el siguiente video puedes ver cómo se forma un cristal iónico:
Propiedades de las sustancias iónicas
- Son sólidos cristalinos. Estos cristales están formados millones de iones de un metal y un no metal, que se ordenan conforme a un patrón que se repite en las tres direcciones del espacio.
- Son duros pero frágiles.
- Son solubles en agua.
- Tienen puntos de fusión y ebullición elevados.
- No conducen la corriente eléctrica en estado sólido.
- Si lo hacen en disolución.


En la siguienete animación puedes observar cómo se disuelven los cristales de sal en el agua. Las moléculas de agua rodean, por un lado a los cationes sodio y, por el otro a los aniones Cl.
TAREAS:
- Busca las definiciones de "punto de fusión" y "punto de ebullición" de una sustancia.
- Explica como un material puede ser a la vez duro y frágil.
- Diseña un experimento para comprobar si es cierto que la sal en estado sólido no conduce la electricidad y, sin embargo, disuelta en agua si lo hace. Debes seguir el siguiente esquema:
- Título del experimento
- Objetivo
- Material
- Procedimiento
SUSTANCIAS COVALENTES
Las podemos clasificar atendiendo a dos criterios:
Si nos fijamos en si los átomos son del mismo o de distintos elementos hablaremos de:
- Sustancias covalentes simples
- Compuestos covalentes
Si nos fijamos en la cantidad de átomos que las constituyen, entonces hablaremos de:
- Moléculas
- Cristales covalentes
A continuación ejemplos:
MOLÉCULAS

El gas oxígeno y el gas ozono son sustancias covalentes simples porque están formadas por átomos del mismo elemento químico.
El agua es un compuesto covalentes porque está formado por átomoa de oxígeno e hidrógeno.
CRISTALES COVALENTES


El diamante es un cristal formado por átomos de carbono unidos por enlaces covalentes, es por tanto una sustancia covalente simple.

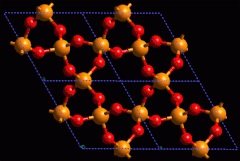
El cuarzo es un cristal formado por átomos de silicio (Si) y oxígeno (O) unidos por enlaces covalentes, se trata de un compuesto covalente.
Propiedades de las sustancias covalentes
- Son mayoritariamente gases a temperatura ambiente. En casos menos frecuentes, pueden ser líquidos (como el agua) o sólidos (como el Iodo).
- No conducen la corriente eléctrica.
- Puntos de fusión y ebullición bajos.
- En el caso de las moléculas covalentes sólidas, son frágiles y quebradizas o blandas y de aspecto céreo.
LAS SUSTANCIAS METÁLICAS

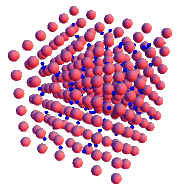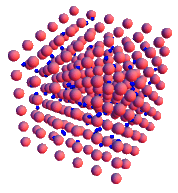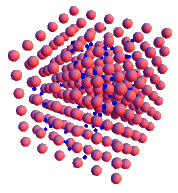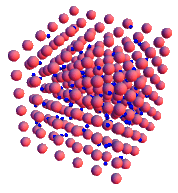
En la imagen observamos cómo se ordenan los átomos de tres metales diferentes: a la izquierda el hierro, en el centro el cinc y a la derecha el cobre.
Propiedades de las sustancias metálicas
- Son sólidos cristalinos, excepto el mercurio, que es líquido.
- Suelen ser bastante duros, al estar unidos los átomos de modo muy compacto.
- Son maleables (obtención de delgadas láminas de material sin que éste se rompa) y dúctiles (pueden estirarse sin romperse permitiendo obtener alambres o hilos), en mayor o menor grado, ya que es posible mover una capa de átomos sobre otra. En este enlace lo puedes ver.
TAREAS:
- Recoge en una tabla las diferencias entre los tres tipos de enlaces: iónico, covalente y metálico.
- Recoge en una tabla las características de los tres tipos de sustancias: iónicas, covalentes y metálicas.
- Realiza un esquema que recoja las distintas formas en que se agrupan los átomos en la naturaleza.


 ACT
ACT



